|
INSTITUCIÓN EDUCATIVA DISTRITAL
TÉCNICO INDUSTRIAL Ciencia, Técnica y Valores Humanos |
|
|
PLAN DE CLASES |
|
|
Fecha de emisión: 21 - 01 –
2020 |
SF
UNIDAD N°2 TEMA N°1.
LOS GASES
LOGROS:
Ø
Explica
y comunica las propiedades de los gases
Ø
Realiza
cálculos a partir de ecuaciones matemáticas que explican las leyes de los
gases.
¿Qué son los gases?
Con el término gas nos
referimos a uno de los tres principales estados de agregación de la
materia (junto a los líquidos y
los sólidos). Se
caracteriza por la dispersión, fluidez y poca atracción entre sus partículas
constitutivas.
Los gases son la
forma más volátil de la materia en
la naturaleza y son sumamente comunes en la vida cotidiana. Así, cuando una
sustancia se encuentra en estado
gaseoso solemos llamarla gas.
Las sustancias líquidas o
sólidas pueden ser transformadas en gas utilizando diferentes procesos. Esta
transformación implica un cambio en las propiedades físicas de las sustancias,
como su estado de agregación. Sin embargo no cambian sus propiedades químicas,
pues las sustancias siguen teniendo la misma estructura química, es decir, no
ocurren rupturas de enlaces
químicos ni se generan nuevas sustancias.
Los gases se
encuentran en todas partes: desde la masa heterogénea de gases que
llamamos atmósfera y
que respiramos como aire,
hasta los gases que se generan dentro del intestino, producto de la digestión y
descomposición, hasta los gases inflamables con que alimentamos nuestras
cocinas y hornos.
Historia de los gases
La palabra gas fue
inventada en el siglo XVII por el científico flamenco Jan Baptista van
Helmont, a partir del término latino chaos (“caos”).
Eligió el nombre por el
aparente grado de desorden que exhiben las moléculas de un gas.
También se conocía a este estado como “estado aeriforme”, pero este
término quedó en desuso.
Las primeras leyes sobre
el comportamiento de los gases fueron consecuencia de su estudio intensivo a
finales del mismo siglo, en especial de sus relaciones entre presión, temperatura y volumen.
Esto condujo a Émile
Clapeyron a formular la ley ideal para todos los gases (“Ley de los
gases ideales”) en 1834.
Gas ideal y gas real
Un gas ideal es un
modelo de gas creado por el ser humano, y que no tiene interacciones entre las
partículas que lo forman, es decir, que no tienen atracción ni repulsión entre
ellas. Por otro lado, un gas real sí presenta estas interacciones.
Cuanto más simple sea la
fórmula química de un gas real y menor sea su reactividad, más se puede
asemejar a uno ideal. Así, los gases monoatómicos, por ejemplo, el helio (He),
son los que se comportan de modo más similar a los gases ideales.
Leyes de los gases
Una de las leyes más
utilizadas para describir el comportamiento de los gases es la Ley de los gases
ideales que, a su vez, puede comprenderse como la combinación de otras leyes:
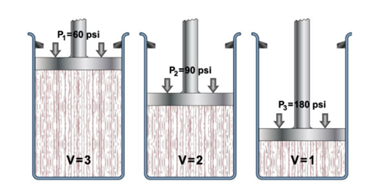
- Ley de Boyle-Mariotte. Determina que el volumen de un
gas varía de forma inversamente proporcional a la presión absoluta del
recipiente donde está contenido, si la temperatura permanece constante. Se
expresa según la ecuación:
- Ley de Gay-Lussac. Explica que la presión de una
masa de gas cuyo volumen se mantiene constante es directamente
proporcional a la temperatura (expresada en grados kelvin) que posea. Esto
se representa de la siguiente manera:
- Ley de Charles. Expresa que la temperatura y el
volumen de un gas son directamente proporcionales cuando la presión es
constante. Esta ley se representa mediante la siguiente ecuación:
En todos los casos casos anteriores V1, P1 y T1 son el volumen, la presión y la temperatura inicial. Mientras que V2, P2 y T2 son el volumen, la presión y la temperatura final. - Ley de Avogadro. Expresa que en iguales
condiciones de presión y temperatura, volúmenes de distintos compuestos
gaseosos contienen el mismo número de partículas.
- Ley de los Gases Ideales. De la combinación de las leyes
anteriores se obtiene la Ley de los gases ideales, cuya ecuación se
representa de la siguiente forma:
Donde P, V y T son la presión, el volumen y la temperatura. Mientras que n es el número de moles del gas y R es la constante de los gases ideales cuyo valor es 8.31451 J/molK.
Tipos de gases
Los gases pueden
clasificarse según su naturaleza química en:
- Combustibles o inflamables. Aquellos que pueden arder, esto
es, generar reacciones explosivas o exotérmicas en presencia del oxígeno u otros
oxidantes.
- Corrosivos. Aquellos que, al entrar en
contacto con otras sustancias, las someten a procesos de reducción u
oxidación intensos, generando daños en su superficie o heridas en caso de
ser materia orgánica.
- Comburentes. Aquellos que permiten mantener
viva una llama o una reacción inflamable, ya que inducen la combustión en
otras sustancias.
- Tóxicos. Aquellos que representan un
peligro para la salud por las reacciones que introducen en el cuerpo de los seres vivos, como los
gases radiactivos.
- Inertes o nobles. Aquellos que presentan poca o
nula reactividad, excepto en situaciones y condiciones determinadas.
Propiedades de los
gases
Los gases presentan las
siguientes propiedades:
- No tienen volumen propio. Ocupan el volumen del contenedor
en el que se encuentren.
- No tienen forma propia. También asumen la de su
contenedor.
- Pueden dilatarse y contraerse. Al igual que los sólidos y los
líquidos, los gases se dilatan si se les aumenta su temperatura, y se
contraen si se enfrían.
- Tienen gran fluidez. Los gases fluyen mucho más que
los líquidos debido a que sus partículas tienen menor interacción. Pueden
fácilmente desplazarse a través de un orificio de un recipiente a otro.
- Tienen alta difusión. Los gases pueden mezclarse
fácilmente entre sí debido al gran movimiento que tienen sus partículas.
- Solubilidad. Los gases pueden ser solubles en
agua o en otros líquidos.
- Se pueden comprimir. Aplicando presión a un gas, se
puede lograr que sus partículas estén más juntas, es decir, se comprime el
gas.
Cambios de estados de
los gases
- Sublimación. Es un proceso físico de cambio de
fase, que permite convertir un sólido en un gas directamente, sin pasar
primero por una etapa líquida. Este proceso es poco común y suele
involucrar condiciones puntuales de presión y de temperatura. Podemos
observarlo en el hielo seco (o hielo de ) a temperatura ambiente: el
bloque sólido desprende un leve vapor que es la sustancia recuperando su
estado gaseoso original.
- Ebullición. Es el proceso mediante el cual un
líquido se transforma en gas. Ocurre cuando toda la masa del líquido se
calienta a una temperatura igual a su punto de ebullición.
- Evaporación. Es un proceso de cambio de fase
sumamente común, que conduce a un líquido a convertirse en gas cuando se
aumenta la temperatura del líquido. Ocurre de manera lenta y gradual. La
ponemos en práctica por ejemplo, en la ducha cuando el agua muy caliente se
convierte en vapor observable como una nube blanquecina.
- Condensación. Es el proceso opuesto a la
evaporación, esto es, un proceso de cambio de fase que conduce del estado
gaseoso al líquido, debido a la pérdida de energía calórica. Esta energía
perdida hace que las partículas del gas vibren más despacio, lo que les
permite aproximarse e interactuar más estrechamente, como ocurre sobre
un vidrio frío en
día lluvioso, o sobre las plantas y
otras superficies con el rocío.
- Sublimación inversa. Es el camino opuesto de la
sublimación, o sea, el paso del estado gaseoso al estado sólido sin pasar
primero por un momento de liquidez. Este proceso requiere de condiciones
de presión y temperatura muy específicas.
Plasma
El estado plasmático de la
materia es considerado un cuarto estado de agregación, pero
presenta enormes semejanzas con el estado gaseoso, ya que básicamente se trata
de un gas ionizado, es decir, un gas cuyas partículas han perdido electrones y
han adquirido una carga electromagnética determinada. Existen plasmas fríos,
como el empleado en las lámparas de “lava”, o plasmas calientes, como el fuego que rodea al Sol.
Algunos ejemplos de gases
son:
- Hidrógeno (H2). Es el gas diatómico más común
del universo entero.
- Helio (He). Insípido, incoloro e inerte, es
el menos soluble en agua de todos los gases.
- Metano (CH4). Es un hidrocarburo gaseoso
de olor desagradable que se obtiene como producto de la descomposición de
la materia orgánica.
- Aire. Es la mezcla heterogénea de
hidrógeno, nitrógeno,
oxígeno, argón y otros gases que respiramos los seres vivos.
Webgrafía
1.
https://humanidades.com/gases/#ixzz8aCDcpZwP
2.
https://humanidades.com/gases/#ixzz8aCD8FRJ
H
3.
https://humanidades.com/gases/#ixzz8aCCU2RId
4.
https://humanidades.com/gases/#ixzz8aCCE1GjC
5.
https://humanidades.com/gases/#ixzz8aCBl4rY5
6.
https://humanidades.com/gases/#ixzz8aCB7pVMA




No hay comentarios:
Publicar un comentario