|
|
INSTITUCIÓN
EDUCATIVA DISTRITAL TÉCNICO INDUSTRIAL Ciencia, Técnica y Valores
Humanos |
|
LEY DE CHARLES Y DE
LOS GASES IDEALES |
UNIDAD N°2. TEMA N°1. LOS GASES: LEY CHARLES Y DE LOS
GASES IDEALES.
LOGROS:
Ø
Explica
y comunica las propiedades de los gases
Ø
Realiza
cálculos a partir de ecuaciones matemáticas que explican las leyes de los
gases.
1 . INICIO.
La ley
de Charles y Gay-Lussac, frecuentemente llamada ley de Charles o ley
de Gay-Lussac, es una de las leyes de los gases ideales. Relaciona el
volumen y la temperatura de una cierta cantidad de gas
ideal, mantenido a una presión constante, mediante una constante de
proporcionalidad directa. En esta ley, Charles dice que, a una presión
constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir
la temperatura el volumen del gas disminuye. Esto se debe a que
"temperatura" significa movimiento de las partículas. Así que, a
mayor movimiento de las partículas (temperatura.), mayor volumen del gas.
La
ley fue publicada primero por Louis
Joseph Gay-Lussac en
1802, pero hacía referencia al trabajo no publicado de Jacques
Charles, de alrededor
de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La
relación había sido anticipada anteriormente en los trabajos de Guillaume
Amontons en 1702.
ENTRA
AL SIGUENTE LINK: Observa el proceso.
https://www.educaplus.org/gases/ley_charles.html#google_vignette
2.
DESARROLLO.
Usada de muchas formas
diferentes, desde globos de aire caliente hasta acuarios. Se expresa por la
fórmula:
Además, puede expresarse como:
V1/T1 = V2/T2
Despejando T1 se obtiene:
T1= (V1 * T2) / V2
Despejando T2 se obtiene:
T2= (V2 * T1) / V1
donde:
V es el volumen
T es la temperatura
absoluta (es decir, medida en Kelvin)
k es la constante de proporcionalidad
Siendo la presión
constante, si la temperatura aumenta, el volumen lo hará también en la misma
proporción (primera ley).
Siendo el volumen
constante, si la presión aumenta, la temperatura lo hará también en la misma
proporción (segunda ley).
1.
CIERRE.
Ejercicios
Resueltos: Ley de Charles
Ø Ejercicio 1 El volumen
inicial de una cierta cantidad de gas es de 200 mL a la temperatura de 293,15
K. Calcule el volumen del gas si la temperatura asciende a 363,15 K y la
presión se mantiene constante. Como la presión y la cantidad de materia se
mantienen constantes, podemos aplicar la ley de Charles:
Ø Ejercicio 2 Una masa de
oxígeno ocupa 200 mL a 100°C. Determine su volumen a 0°C, si la presión se
mantiene constante. Como la presión y la cantidad de materia se mantienen
constantes, podemos aplicar la ley de Charles
LEY DE LOS GASES IDEALES
1.
INICIO
Una vez comprendido los
temas de las leyes de los gases, tales como la ley de Boyle - Mariotte, la Ley de Charles,
la ley de Gay - Lussac, y finalmente la ley general del estado gaseoso. Es importante conocer también la ley
de los gases ideales, porque son fundamentales para entender por completo la
teoría general de los gases, un tema de gran relevancia en la termodinámica y estudios
de química.
2.
DESARROLLO:
¿Qué es un gas ideal?
Para poder comprender
completamente el tema del gas ideal o gas perfecto, debemos
prestar atención a lo siguiente, un gas ideal o perfecto realmente no existe,
es un gas hipotético cuyo compartimiento de las variables de presión, volumen y
temperatura se pueden describir completamente por la ecuación del gas ideal.
Dicha ecuación especifica la relación entre las cantidades de P, V, T y n.
Las moléculas que componen
a un gas ideal no se suelen atraer o repeler entre si, y su volumen es
despreciable en comparación con el volumen del recipiente que lo contiene.
Aunque en nuestra naturaleza no exista el caso de un gas ideal, las diferencias
entre el comportamiento de un gas real en márgenes de temperatura y presión no
alteran sustancialmente los cálculos, por lo que podemos hacer uso de la
ecuación con toda la seguridad, para resolver diversos ejercicios de gases.
Constante Universal de
los Gases
En nuestro estudio de las
leyes de los gases, hemos visto la relación de la temperatura, presión y
volumen. Tal como se muestra en la siguiente fórmula de la ley general de los
gases:
Dónde:
P = Presión absoluta a la que se encuentra
el gas
V = Volumen ocupado por el gas
n = Número de moles del gas que se calcula
dividiendo su masa entre su peso molecular
![]()
R = Es la constante universal de los gases y
su valor depende de las unidades usadas para su cálculo.
La ecuación de la ley
de los gases ideales es una de las ecuaciones más utilizadas en
fisicoquímica, pues nos permite realizar varios cálculos conociendo el valor de
R, ya que establece una relación entre la presión, el volumen, la temperatura y
número de moles de un gas
En conclusión, la fórmula
que vamos a emplear para la ley de los gases ideales o gases perfectos es la
siguiente:
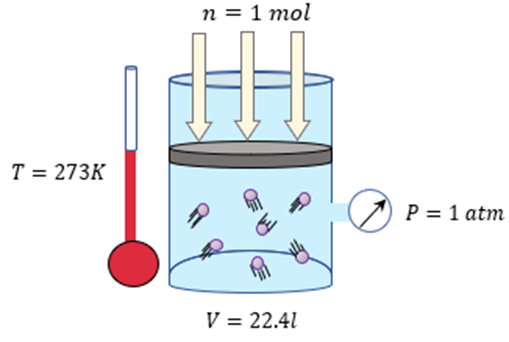
Para que podamos calcular
el valor de R , tenemos que considerar que un mol de cualquier
gas ideal y en condiciones normales de temperatura y presión, es decir a una atmósfera
y 273 K, ocupa un volumen de 22,413 litros.
Por lo tanto, al despejar
R de la ecuación anterior, tenemos:
𝑅=𝑃𝑉𝑛𝑇=(1𝑎𝑡𝑚)(22.413𝑙)(1𝑚𝑜𝑙)(273𝐾)=0.0821𝑎𝑡𝑚⋅𝑙𝑚𝑜𝑙⋅𝐾
Qué también es equivalente
a:
R = 8.32 J/mol K
Para entender a fondo esta
ley, veamos algunos ejercicios resueltos de la ley de los gases ideales o gases
perfectos.
3.
CIERRE. Analice los ejercicios Resueltos de la Ley de
los gases ideales
Problema 1.- Una masa de hidrógeno gaseoso ocupa un
volumen de 230 litros en un tanque a una presión de 1.5 atmósferas y a una
temperatura de 35°C. Calcular, a) ¿Cuántos moles de hidrógeno se tienen?, b)¿ A
qué masa equivale el número de moles contenidos en el tanque?
Solución:
Si leemos el problema
nuevamente, vemos que nos proporcionan datos como el volumen, la presión y la
temperatura. Y nos pide calcular los moles de hidrógeno,es decir el valor de
"n", después nos pide convertir esa cantidad de moles a unidades de
masa, por lo que el problema es muy sencillo. Recordemos la fórmula:
Datos:
𝑉=230𝑙
P= 1,5 atm
T= 35°c + 273= 308K
Nota: Observe que hemos convertido los grados
celcius a la escala absoluta de Kelvin, sumando 273.
a) Obtener los números de moles de
la masa de hidrógeno gaseoso
Veamos la ecuación de la
ley de los gases ideales, de la fórmula:
𝑃𝑉=𝑛𝑅𝑇
Despejamos a
"n", y tenemos:
𝑛=𝑃𝑉𝑅𝑇
Ahora si podemos sustituir
nuestros datos
𝑛=𝑃𝑉𝑅𝑇=(1.5𝑎𝑡𝑚) (230𝑙)(0.0821𝑎𝑡𝑚⋅𝑙𝑚𝑜𝑙⋅𝐾)(308𝐾)=345𝑎𝑡𝑚⋅𝑙25.29𝑎𝑡𝑚⋅𝑙𝑚𝑜𝑙=13.64𝑚𝑜𝑙
Por lo que la cantidad de
número de moles es de 13.64 moles
b) Convertir en masa el
número de moles
Al ser hidrógeno gaseoso
nos referimos a que su peso atómico o masa molar es una molécula diatómica,
compuesta por dos átomos de hidrógeno 𝐻2 Y que su peso molecular (PM) es igual a 2 g/mol (porque es
diatómica), entonces tenemos:
𝑚=𝑛(𝑃𝑀)=(13.64𝑚𝑜𝑙)(2𝑔𝑚𝑜𝑙)=27.28𝑔
Es decir que tenemos una
masa de 27.28 gramos
Problema 2.- El hexafluoruro de azufre (SF6) es un
gas incoloro e inodoro muy poco reactivo. Calcule la presión (en atm) ejercida
por 2.35 moles del gas en un recipiente de acero de 5.92 litros de volumen a
71.5°C.
Solución:
El problema es muy
sencillo nuevamente de resolver, si volvemos a leer nos damos cuenta que
tenemos los datos del número de moles de la sustancia, un volumen y una
temperatura. También sabemos el valor de nuestra constante de gases ideales.
Ahora es momento de colocar nuestros datos:
Datos:
𝑛=2.35𝑚𝑜𝑙
𝑉=5.92𝑙
𝑇=71.5∘𝐶+273=344.5𝐾
a) Obteniendo la
presión ejercida por el gas
De nuestra ecuación de los
gases ideales
𝑃𝑉=𝑛𝑅𝑇𝑚=𝑛(𝑃𝑀)
Despejamos a la presión:
𝑃=𝑛𝑅𝑇𝑉
Sustituimos nuestros datos
en la fórmula:
𝑃=𝑛𝑅𝑇𝑉=(2.35𝑚𝑜𝑙) (0.0821𝑎𝑡𝑚⋅𝑙𝑚𝑜𝑙⋅𝐾)(344.5𝐾)5.92𝑙=11.23𝑎𝑡𝑚
Por lo que la presión es
de 11.23 atmósferas
Problema 3.- Se coloca 160 gramos de oxígeno a 27°C
en un recipiente con capacidad de 5 litros. Considerando que el oxígeno se
comporta como un gas perfecto. ¿Cuál es el valor de la presión ejercida por la
sustancia?
Solución:
Para poder solucionar este
problema de la ley de los gases ideales, basta con captar todos los datos que
nos proporcionan como la cantidad de gramos de oxígeno, así como saber a cuánto
equivale la masa molar del oxígeno, sabiendo que se trata de dos moléculas, es
decir 32 gramos. También contamos con la temperatura, y volumen. Nos piden
calcular el valor de la presión ejercida de la sustancia, así que no será tan
complicado de resolver.
- Obtener el valor de la presión
ejercida por la sustancia.
Datos:
a) Obtener la presión
ejercida por la sustancia
No contamos con la
cantidad de moles "n" de la sustancia, pero la podemos obtener
empleando la siguiente fórmula:
Por lo que tenemos la
cantidad de 5 moles, ahora si podemos seguir con nuestro cálculo
De la ecuación de los
gases ideales, tenemos:
Despejamos a la presión:
Sustituyendo los datos en
la fórmula:
Obtenemos un resultado de 24.63 atmósferas

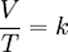





No hay comentarios:
Publicar un comentario