INSTITUCIÓN EDUCATIVA DISTRITAL TÉCNICO INDUSTRIAL
ASIGNATURA: QUÍMICA INORGÁNICA– GRADO 10°
DOCENTE: JOSÉ LUÍS ESTRADA FLÓREZ
TEMA: CONCEPTOS BÁSICOS DE LA ESTRUCTURA ATÓMICA.
LOGROS:
- Explica la estructura atómica según diferentes teorías.
- reconoce que los modelos de la ciencia cambian con el tiempo y que varios de ellos pueden ser válidos simultáneamente.
Indicador de desempeño: Realiza cálculos utilizando la teoría de algunas propiedades de los átomos y lleva a cabo comparaciones e inferencias a partir de estos.
Competencias:
- Identifica y analiza los conceptos que contribuyeron a la explicación de la estructura de la materia a través de los modelos atómicos.
- Identificar algunas propiedades generales de la química y realiza predicciones a partir de estas.
- Justifica el comportamiento de partículas elementales
ACCIONES: Copia en tu cuaderno.
1. inicio. Presaberes.
Con base ne la siguiente lectura responde:
a) ¿Qué entiendes por modelo atómico?
b) ¿ Será que un solo modelo sirve para explicar la estructura de la materia?
En la búsqueda de establecer leyes universales o paradigmas comprobados a través del método científico, numerosos científicos —sobre todo de las llamadas ciencias exactas— han propuesto esquemas o representaciones gráficas que permitan explicar numerosos fenómenos a partir de sus propuestas teóricas y experimentales. Los modelos, que constituyen tales esquemas, se convierten en una especie de guía a seguir para el resto de los investigadores y, en líneas generales, permiten un mejor entendimiento de los resultados de sus investigaciones.
La explicación del comportamiento y la estructura del átomo, que es la partícula mínima e indivisible de la materia, fue objeto de estudio por parte de diferentes científicos apasionados por áreas como la física, la química y la matemática. De allí que se pensara en el establecimiento de modelos para su mejor comprensión.
Los llamados modelos atómicos responden a las interrogantes cómo son y cómo se comportan los átomos. Gracias a una abstracción de la lógica de los átomos y su posterior traslado a un esquema, es posible que los modelos puedan representar de forma sencilla los grandes aportes en el estudio de los átomos.
Los modelos atómicos han sido acompañados por el apellido de los científicos que los han propuesto y explicado a través de numerosos estudios y experimentos; pero su validez caduca cuando nuevos estudios dan muestra de error en todos o algunos de sus postulados, para plantear entonces un nuevo modelo.
2. Desarrollo. Bases teóricas.
Tipos de modelos atómicos
Como todo modelo, los atómicos buscan asociar un concepto con una representación gráfica. En la historia de la humanidad, son muchos los modelos que han perseguido mostrar esquemáticamente el comportamiento y estructura de los átomos; sin embargo, los más reconocidos pertenecen a los científicos Ernest Rutherford, Joseph John Thomson, John Dalton, Hantaro Nagaoka, Niels Bohr, Arnold Sommerfeld, Erwin Schrödinger y Paul Dirac.
Es importante destacar que cada uno de los modelos atómicos se corresponden con aspectos como las influencias teóricas y académicas propias de la época y el lugar donde fueron realizados, la consideración de las teorías y los postulados propuestos con anterioridad, la postura epistemológica del investigador y los problemas que los científicos se plantearon resolver.
A Demócrito de Abdera, filósofo y matemático de origen griego, se le debe el descubrimiento de los átomos y la postulación de un primer modelo o aproximación al estudio de su comportamiento y estructura, esto a partir de su obra Teoría Atómica del Universo. A través de su modelo, que estaba basado en estudios filosóficos y no experimentales, Demócrito sentó las bases para el estudio de los átomos al definirlos como las partículas mínimas, indivisibles e indestructibles de la materia.
Modelo Atómico de Dalton:
Actividad N°1: Escribe en tu cuaderno la siguiente postura y consulta los postulados de John Dalton sobre la estructura atómica.
Luego de los trascendentales aportes de Demócrito, entre 1803 y 1807, John Dalton, químico y matemático británico, postuló y desarrolló con base científica un modelo atómico, tomando como base lo propuesto por el filósofo griego.
El Modelo Atómico de Dalton reconoce en los átomos las mismas características que le había dado Demócrito en su definición, pero incluyó entre sus postulados aspectos como que los átomos de un mismo elemento se igualan en cuanto a sus propiedades y su masa, y que los átomos de elementos distintos tienen también diferentes propiedades y masa.
Modelo Atómico de Thomson o Modelo del Pudín de Pasas.
Actividad n°2.
a) Copia y dibuja la postura del modelo de Thomson.
b) Consulta, dibuja y explica el experimento de Thomson para el explicar su modelo atómico. da clic aquí: experimento de Thomson
El trabajo del físico británico Joseph John Thomson —quien es reconocido por el descubrimiento de los electrones, que no son más que partículas subatómicas con carga negativa— también involucró la creación de un modelo atómico que no solo es conocido por el apellido de su autor sino que también se le llama Modelo del Pudín de Pasas, debido al parecido de la representación gráfica del modelo con ese postre.
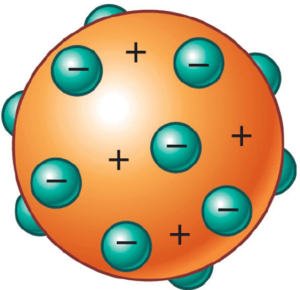
En 1904 vio la luz el modelo de Thomson, en el que se busca explicar la estructura de los átomos. La analogía con el pudín pasas radica en que, para este autor, los electrones están incrustados y distribuidos de forma uniforme en el átomo positivo.
Modelo Atómico de Rutherford.
Actividad N°3.
a) copia la postura del modelo de Ernest Rutherford.
b) consulta, dibuja y explica el experimento de Rutherford para explicar su modelo atómico. Da clic en experimento de Rtherford
El modelo atómico planteado por Ernest Rutherford —a quien también se le reconoce el descubrimiento de los protones en 1891 y grandes aportes para el hallazgo de los neutrones¬— establece que en la estructura del átomo hay un núcleo en el que están concentrados los protones, que son partículas subatómicas con carga positiva, y casi la totalidad de la masa del átomo. Asimismo, Rutherford postuló que había una compensación entre la carga positiva de los protones y la negativa proveniente de los electrones, relación en la que ambos son iguales en número. En 1908 descubre las partiículas alfa y en 1911 propone su modelo atómico
Modelo Atómico de Bohr.
Actividad N°4.
a) copia la postura del modelo Niels Bohr.
b) consulta, dibuja y explica el experimento de Bohrr para explicar su modelo atómico. Da clic en Experimento de Bohr.
c) consulta el cuerpo negro propuesto por Max Plank.
d) El efecto fotoeléctrico.
e) Dualidad onda-particula de Louis De Broglie.
f) principo de incertidumbre de Werner Heisemberg
En 1913, el físico danés Niels Bohr propuso su propio modelo atómico a partir de buena parte de las teorías y postulados propuestos por su maestro Ernest Rutherford, es por eso que este modelo también es conocido como Bohr-Rutherford.
La propuesta de Bohr-Rutherford es un modelo cuantizado, que fue desarrollado para explicar cómo ocurre el trazado de órbitas estables en torno al núcleo. Más que representar gráficamente la estructura del átomo desde el punto de vista físico, este modelo persigue explicar su funcionamiento mediante la definición de ecuaciones que así lo permitan.
Modelo Atómico de Sommerfeld
Actividad N°5.
a) copia la postura del modelo Sommerfeld.
b) consulta, dibuja y explica el experimento de Sommerfeld para explicar su modelo atómico. Da clic en modelo Sommerfeld
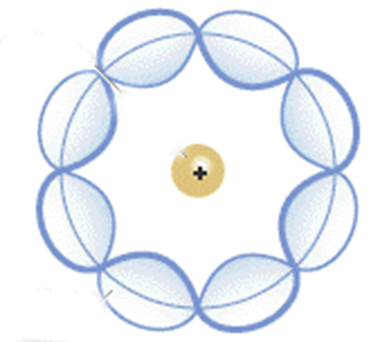
En el Modelo Atómico de Bohr las orbitas de los electrones alrededor del núcleo del átomo eran circulares, pero el físico de origen alemán, Arnold Sommerfeld, descubrió y explicó en su modelo que estas órbitas definidas por los electrones tenían una forma elíptica. Este fue, sin duda, uno de los más grandes aportes de Sommerfeld en la construcción del conocimiento en cuanto al comportamiento de la estructura atómica.
Sommerfeld, que toma como base la Teoría de la Relatividad propuesta por Albert Einstein, planteó en 1916 que al igual que los electrones, el núcleo del átomo se mantiene en movimiento alrededor de un centro de masas. Asimismo, especificó que la corriente eléctrica que posee el electrón es minúscula.
Modelo Atómico de Schrödinger
Actividad N°6.
a) copia la postura del modelo Scrodinger.
b) consulta, dibuja y explica el experimento de Scrodinger para explicar su modelo atómico. Da clic en Scrodinger
Desde una perspectiva cuántica y no relativista, el modelo de Erwin Schrödinger, un físico de origen austríaco, busca explicar que los movimientos que realizan los electrones alrededor del núcleo no ocurren de forma determinada.
Entre los aportes de este modelo se ubica la generación de ecuaciones matemáticas para describir la evolución de los electrones alrededor del núcleo del átomo, es así como fundamenta la llamada ecuación de Schrödinger, cuyo desarrollo le valió ganar el Premio Nobel de Física en 1933 y ser considerado como uno de los padres del método atómico actual.
Responde escogiendo la respuesta correcta y argumentándola:
1. El físico danes Niels Bohr propuso el siguiente modelo:
a. Orbital. b. Planetario. c. Pastel de pasas. d. Nubes cósmicas.
2. Cuál de las siguientes frases no corresponde al modelo atómico propuesto por Rutherford?
a. Propone el nuevo modelo nuclear.
b. El núcleo posee carga positiva.
c. Los electrones se desplazan alrededor del núcleo, tal como lo hacen los planetas alrededor del Sol. d. El alrededor del núcleo giran partículas con carga negativa a las que llamo electrones.
3. La teoría atómica se refiere a:
a. Diversas concepciones que se han tenido acerca del átomo y su constitución.
b. Al modelo planetario.
c. Diversas concepciones que se han tenido acerca de las moléculas y su constitución.
d. Diversas concepciones que se han tenido acerca de los elementos y su constitución.
Webgrafía:
https://cuantozombi.com/2012/10/01/el-experimento-de-thompson/
https://www.rolscience.net/2016/08/experimento-de-rutherford.html
https://astrojem.com/teorias/modelobohr.html
http://www.quimicas.net/2015/05/el-modelo-atomico-de-sommerfeld.html
http://www.quimicas.net/2015/05/el-modelo-atomico-de-schrodinger.html
https://www.youtube.com/watch?v=TSwHzAtb4vs
https://www.youtube.com/watch?v=GsdoJT_WLC8. LEY DE MAX PLANCK