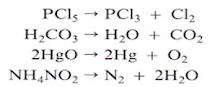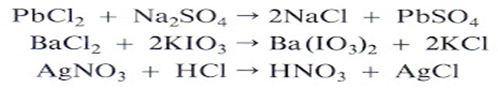|
|
INSTITUCIÓN EDUCATIVA DISTRITAL TÉCNICO
INDUSTRIAL
Ciencia, Técnica y Valores
Humanos
|
|
GUÍA Nº3. DE QUIMICA TEMA Nº2
|
TEMA Nº2: BALANCEO DE ECUACIONES QUÍMICA: MÉTODOS DEL TANTEO Y REDOX
INDICADOR DE DESEMPEÑO.
Balancea correctamente ecuaciones químicas y establece relaciones cuantitativas
entre los componentes de esta, basándose en las leyes ponderales.
- Maneja con criterio los
procedimientos para balancear ecuaciones químicas.
- Explica con razones la
ocurrencia de reacciones químicas en diferentes procesos.
- Uso comprensivo de la
información científica.
- Explicación de fenómenos.
5. Indagación
1.
INICIO.
Presaberes: Reacción química, reactivos y productos, simbología, leyes
ponderales.
Las leyes ponderales son un conjunto de leyes
que tienen como objetivo el estudio del peso relativo de las sustancias, en una
reacción química, entre dos o más elementos químicos. Por lo tanto se puede
decir que se divide en cuatro importantes leyes como lo son:
- Ley
de conservación de la masa o ley de Lavoisier. 1789:
Este resultado se debe al químico francés A.
L. Lavoisier, quien lo formulo en 1774. Considerando que “La ley de la
conservación de la masa dice que en cualquier reacción química la masa se
conserva, es decir, la masa y la materia ni se crea ni se destruye, sólo se
transforma y permanece invariable.”
- Ley
de las proporciones definidas o ley de Proust. 1801.
En 1808, tras ocho años de las
investigaciones, Proust llego a la conclusión de que para formar un determinado
compuesto, dos o más elementos químicos se unen y siempre en la misma
proporción ponderal.
- Ley
de Dalton de las proporciones múltiples. 1803
Dalton elaboró la primera teoría atómica y
realizó numerosos trabajos de los cuales formuló en 1803: “Cuando dos o más
elementos pueden formar más de un compuesto, las cantidades de uno de ellos que
se combinan con una cantidad fija del otro, guardan entre sí relación de
números enteros sencillos”.
- Ley
de Richter a de las proporciones reciprocas o equivalentes, masas de
combinación o masas equivalentes. 1792
Fue enunciada por el alemán J. B. Richter en
1792 y dice que los pesos de dos sustancias que se combinan con un peso
conocido de otra tercera son químicamente equivalentes entre sí.
2.
DESARROLLO.
REACCIONES DE ÓXIDO-REDUCCIÓN.
Reducción: Es el proceso mediante el cual un
determinado elemento químico capta electrones, lo que se traduce en una
disminución de su índice de oxidación.
Oxidación: Es el proceso mediante el cual un
determinado elemento químico cede electrones, lo que se traduce en un aumento
de su índice de oxidación.
Las reacciones de óxido-reducción o redox, son los
procesos químicos en los que tiene lugar alguna variación en el estado de
oxidación o número de oxidación. Esta variación es, a su vez, la consecuencia
de una transferencia de electrones.
Estado de oxidación: se define como la carga iónica parcial existente sobre un átomo
constituyente de una molécula o ión.
Reglas para determinar el Estado de oxidación, EDO:
· El
estado de oxidación del átomo en un elemento es cero. Ejemplos: O en O2,
H en H2, Al en el metal, etc. En todos ellos el EDO=0.
· El
EDO de un ión monoatómico es idéntico a su carga. Por ejemplo, para el Cu2+ el
EDO del Cu es +2, para el Cl-, el EDO del Cl es –1.
· Los
metales alcalinos siempre que estén formando parte de un compuesto tienen EDO
+1, y los metales alcalinos térreos tienen EDO +2 cuando están formando parte
de un compuesto.
· Los
halógenos, cuando forman parte de una sal binaria, tienen EDO –1 y los no
metales calcógenos, cuando forman parte de una sal binaria, tienen EDO –2.
· El
estado de oxidación del hidrógeno, cuando está formando parte de un compuesto,
tiene EDO +1, excepto en los hidruros metálicos donde el EDO es –1.
· El
estado de oxidación del oxígeno en los compuestos es –2, con excepción de los
peróxidos; por ejemplo, en el peróxido de hidrógeno o agua oxigenada, H2O2,
o en los peróxidos de los metales alcalinos, de fórmula general M2O2 y
en los peróxidos de los metales alcalino térreos, de fórmula MO2 donde
el EDO del oxígeno es –1.
La suma de los estados de oxidación de los átomos componentes de una
molécula neutra debe ser igual a cero, e igual a la carga en el caso de los
iones poli atómicos.
Ejemplos: Hallar el número de oxidación del carbono en el carbonato de
calcio (CaCO3) y del cromo en el ión Dicromato Cr2O7-2.
CaCO3
Ca C O3
(+2) + (X) + 3(-2) =
0
2 + X
- 6 = 0
X
= +4
Cr2 O7-2
Cr2 O7-2
2
X + 7(-2) = -2
2
X - 14 = -2
2X = 12
X =
+6
Es importante tener claro los conceptos de oxidante,
reductor, semirreacción de oxidación y semirreacción de
reducción.
Agente Reductor:
Es la sustancia que contiene el elemento cuyo EDO
aumenta. Esta sustancia se oxida y reduce a la otra sustancia.
Agente Oxidante:
Es la sustancia que contiene el elemento cuyo
EDO disminuye. Esta sustancia se reduce y oxida a la otra sustancia.
Semirreacción de oxidación:
Es el proceso en que un elemento aumenta su EDO,
para lo que es necesario que el agente reductor ceda electrones.
Semirreacción de reducción:
Es el proceso en que un elemento disminuye su EDO,
para lo que es necesario que el agente oxidante capte electrones.
RECUERDA:
· La sustancia que
cede electrones, se oxida.
· La sustancia que
gana electrones, se reduce.
Puede sonar raro que la sustancia que se oxida pierda electrones y la
sustancia que se reduce gane electrones, porque uno se pregunta, ¿cómo se puede
reducir una sustancia que está ganando algo? Precisamente porque lo que está
ganando son electrones, que tienen carga negativa.
Uno en la vida puede ganar muchas cosas positivas, pero también puede
ganarse problemas, que son cosas negativas. Por suerte, ganar o perder
electrones no es problema para ninguna sustancias, pero puede serlo para ti si
no sabes cómo responder una pregunta de oxidación reducción.
· La
sustancia que se oxida al reaccionar, reduce a la otra sustancia con la cual
está reaccionando, porque le está regalando electrones: decimos que es un
reductor.
· La
sustancia que se reduce al reaccionar, oxida a la otra sustancia con la cual
está reaccionando, porque le está quitando electrones: decimos que es un
oxidante.
MÉTODOS PARA BALANCEAR ECUACIONES:
Método del Tanteo.
Consiste en colocar números grandes
denominados "Coeficientes" a la derecha del compuesto o elemento del
que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre
los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación
química:
Fe2O3 + H2O 
Fe (OH)
3
Comenzamos por el hierro, el oxígeno y después el hidrógeno.
Miramos que en el hierro hay 2 en los reactivos y uno en los productos , por lo tanto colocamos como coeficiente en el hierro de los productos un 2
Fe2O3 + H2O  2 Fe (OH)3
2 Fe (OH)3
Continuamos: ¿Cuántos oxígenos hay en
el primer miembro? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el segundo? Encontramos
6 porque el dos (situado a la izquierda del Fe) se multiplica por el subíndice
encontrado a la derecha del paréntesis final y se multiplica 2*3 = 6
Por lo tanto en el segundo miembro
hay 6 oxígenos.
Entonces colocamos un 3 del lado
izquierdo del hidrógeno en
el primer miembro para tener 6 oxígenos
Posteriormente, Vamos con los
hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo
igualmente 6.
Entonces concluimos de la siguiente
manera:
Fe2O3 + 3 H2O  2 Fe (OH)
2 Fe (OH)
Por lo tanto, la ecuación está
balanceada.
Método de oxidación reducción o Redox.
En la siguiente dirección puedes ver los vídeos
sobre reacciones de óxido reducción y la explicación de cómo se balancean. Para
ello, busca a la derecha del vídeo donde aparecen los demás vídeos. Reacciones Redox. Haga
clic en las palabras resaltadas
En la siguiente dirección vas a
observar un vídeo de reacciones redox con sustancias reales. Reacciones redox.
Haga clic aquí.
3.
CIERRE
Con base en las observaciones hechas, responde las siguientes preguntas.
1. ¿Qué Tipos de reactivos se utilizan en cada una de las cinco
disoluciones? ¿Cómo se preparan las disoluciones? Explica.
Escribe la fórmula química de las sustancias y el símbolo químico de los
elementos metálicos usados.
2. ¿Qué sustancias se reducen y qué sustancias se oxidan?
3. Escriba las ecuaciones químicas para cada una de las reacciones y balancéelas.
4. Describa que ocurrió en cada reacción.
5. Consulta en que consiste una pila o celda electroquímica, haz un
dibujo o esquema de la pila donde muestres todos sus componentes, incluidos las
sustancias químicas.
NOTA: Recuerde que está observando, por lo tanto, debes estar muy
concentrado. Si es necesario detenga el video y vaya anotando.
Webgrafía.
 Fe (OH)3
Fe (OH)3  2 Fe (OH)3
2 Fe (OH)3  2 Fe (OH)
2 Fe (OH)