|
INSTITUCIÓN EDUCATIVA DISTRITAL TÉCNICO INDUSTRIAL Ciencia, Técnica y Valores
Humanos |
|
|
GUÍA DE QUÍMICA Nº3 TEMA Nº1 |
HONOR
TEMA Nº1: REACCIONES Y ECUACIONES QUÍMICAS.
INDICADOR DE DESEMPEÑO: Identifica claramente los diferentes tipos de reacciones químicas y los relaciona con algunas sustancias de uso cotidiano.
1. Relaciona los cambios químicos con las propiedades macroscópicas de la materia y con la energía calórica.
2. Describe diferentes reacciones en procesos industriales y su relación con el desarrollo tecnológico.
3. Identifica y describe diversos cambios químicos en la vida cotidiana y en el ambiente.
4. Asume con responsabilidad los trabajos individuales y grupales, respetando la opinión de sus compañeros
1. INICIO.
El hombre vive rodeado de muchos cambios químicos, algunos independientes de su voluntad, como son, la fotosíntesis, la corrosión de algunos metales, la descomposición de los alimentos, etc.; muchos otros son provocados por él mismo, como la combustión de los derivados del petróleo, la preparación de fertilizantes, etc.
Desde siempre el hombre ha querido entender la naturaleza de los cambios químicos para poder controlarlos a su voluntad. Conforme logró el conocimiento de las fórmulas, de las leyes que rigen las combinaciones, la química ha permitido que la humanidad disfrute de innumerables ventajas materiales, aunque a veces vayan acompañadas de un deterioro ecológico, que suele ser consecuencia de un uso inadecuado de los cambios químicos.
2. DESARROLLO.
En una ecuación química tanto la materia que se
trasforma como la materia que resulta de esta transformación se representa por
medio de su fórmula química, a la(s) primera(s) se le llama: “Reactantes” o
“Reactivos” y se colocan a la izquierda de la flecha que indica “se
transforma”, y a la(s) segunda(s) se le denomina “Productos” y se colocan a la
derecha de la flecha.
Ejemplo, la reacción química en la que el metano (CH4) o el gas natural arde con oxígeno (O2) formando dióxido de carbono (CO2) y agua (H2O). Si consideramos que sólo intervienen estas cuatro sustancias, la fórmula (en general, formas abreviadas de sus nombres) sería:
Esta ecuación se lee de la siguiente manera: El gas metano se combina o reacciona con el gas oxígeno y aplicando calor, se transforma en dióxido de carbono que se desprende en forma de gas, además de agua en forma de vapor y energía.
Si observas el signo más (+) en el lado de los
reactantes se lee como: “se combina o reacciona con” mientras que en el lado de
los productos se lee como: “además de”.
Si describimos la combustión del carbono como: “Al hacer
reaccionar carbono con oxígeno (se produce
combustión)) y se formará dióxido de carbono”. La ecuación
sería:
TIPOS DE REACCIONES QUÍMICAS.
La materia experimenta miles de reacciones químicas, por lo que estudiarlas una por una serían prácticamente imposibles, afortunadamente los químicos han encontrado que estas reacciones se pueden clasificar según el proceso y según la energía.
SEGÚN EL PROCESO: se clasifica en cuatro grandes grupos.
1.- Combinación o síntesis.
Este tipo de reacciones se presentan cuando dos o más sustancias reaccionan para producir un solo producto.
En forma general estas reacciones se representan como:
Algunos ejemplos son:
2.- Reacciones de descomposición.
Las reacciones de descomposición se presentan cuando una sustancia se transforma en dos o más sustancias. La sustancia que se descompone siempre es un compuesto y los productos pueden ser elementos o compuestos. Por lo general es necesario aplicar calor para que esta reacción se lleve a cabo.
La ecuación general que representa a las reacciones de descomposición es:
Δ (calor)
Algunos ejemplos son:
Δ
Δ
3.- Reacciones de simple sustitución o
desplazamiento.
Las reacciones de simple sustitución se presentan
cuando un elemento reacciona substituyendo o reemplazando a otro dentro de un
compuesto. A estas reacciones también se les conoce como reacciones de
sustitución simple o de desplazamiento.
La ecuación general que representa a este tipo de
reacciones es la siguiente:
Algunos ejemplos son:
Fe (s) + CuSO4 (ac) FeSO4 (ac) + Cu (s)
Sn (s) + HCl (ac) SnCl2 (ac) + H2 (g)
Cl2 (g) + NaBr (ac) NaCl (ac) + Br2 (g)
4.- Reacciones de doble desplazamiento. Las reacciones de doble desplazamiento o metátesis se presentan cuando dos compuestos participan en una reacción, donde el catión (+) de uno de los compuestos se combina con el anión (-) del otro. Esta reacción se representa con la siguiente ecuación general:
Algunos ejemplos de estos tipos de reacciones son:
La reacción HCl con el CaCO3, que produce cloruro de calcio (CaCl2), agua (H2O) y dióxido de carbono (CO2) que es el gas que se desprende y produce la efervescencia.
2 HCl (ac) +
CaCO3 (s) CaCl2 (ac)
+ H2O (l) + CO2 (g)
La reacción de los antiácidos [ejemplo Mg(OH)2] con el ácido del jugo gástrico del estómago (HCl).
2 HCl (ac) +
Mg(OH)2 (ac) MgCl2 (ac) + 2 H2O (l)
Considera si en el proceso químico el sistema libera o absorbe calor.
Se
divide en dos: EXOTÉRMICA y ENDOTÉRMICA.
EXOTÉRMICA: Son las reacciones que liberan o
emiten energía en forma de calor o de luz. En estas reacciones, la energía
final de los productos es mayor que la energía inicial de los reactivos; por lo
tanto, la variación de energía es positiva.
Ejemplos:
la quema de una vela, una explosión, una mezcla de agua y ácidos fuertes.
ENDOTÉRMICA: Son las reacciones químicas que absorben energía en forma de calor. En estas reacciones, los productos tienen más energía que los reactivos; por lo tanto, la variación de energía es positiva. Suelen estar asociadas a la disociación de las moléculas. Ejemplos: La fotosíntesis, la producción de ozono, la evaporación del agua líquida y la sublimación de dióxido de carbono.
REPRESENTANDO
REACCIONES QUÍMICAS
Los cambios irreversibles corresponden a
los cambios químicos, donde el cambio se traduce en la obtención de nuevas
sustancias. Por ejemplo, al aplicar fuego a un trozo de papel,
éste cambia irreversiblemente. En su lugar aparece un gas (humo) y queda ceniza
del tipo carboncillo. Este cambio químico puede describirse como una reacción
química entre el papel y el oxígeno del aire (reactantes de la
reacción) para originar cenizas y humo (productos de la reacción).
Reacción química para la combustión del papel:
PAPEL + OXÍGENO CENIZAS + HUMO
REACTANTES PRODUCTOS
Las reacciones químicas representadas a través del uso de fórmulas se conocen como ecuaciones químicas. Con las ecuaciones químicas podemos conocer la composición atómica exacta de cada uno de los reactantes y de los productos.
Por ejemplo,
sabemos que al combinar químicamente hidrógeno (H) con oxígeno (O) se obtiene
agua (H2O). Al representar esta reacción en una ecuación química sabremos
cuantos átomos de cada elemento participan en esta reacción. La ecuación
química para esta misma reacción
sería:
2 H2 + O2
![]() 2H2O
2H2O
Cuántas moléculas de
hidrógeno participan en la reacción: ________________
3. CIERRE. Identifica el tipo de reacción química según sea el
caso:
a.
c.
d.
Webgrafía.
1. http://www.comoseresuelvelafisica.com/2012/08/Ecuaciones-Quimicas-Clasificacion-de-las-reacciones-quimicas.html
2. http://www.comoseresuelvelafisica.com/2012/08/Ecuaciones-Quimicas-Clasificacion-de-las-reacciones-quimicas.html



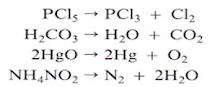

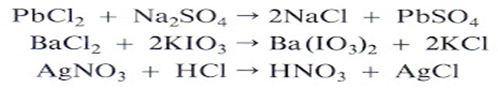
No hay comentarios:
Publicar un comentario