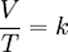|
INSTITUCIÓN
EDUCATIVA DISTRITAL TÉCNICO INDUSTRIAL Ciencia, Técnica y Valores
Humanos |
|
|
PROBLEMAS PROPUESTOS DE LA LY DE LOS GASES |
INDICADOR DE DESEMPEÑO:
Ø Utiliza
los conocimientos básicos sobre la ley de los gases para resolver problemas
planteados.
Ø
Comprende que el comportamiento de un gas real y
de un gas ideal está determinado por las relaciones entre Temperatura (T),
Presión (P), Volumen (V) y Cantidad de sustancia (n)
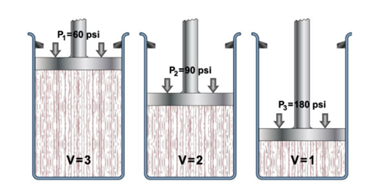
EJERCICIOS PROPUESTOS DE LA LEY DE BOYLE
Problema 1.-
Una muestra de oxígeno ocupa 4.2 litros a 760 mm de Hg. ¿Cuál será el volumen
del oxígeno a 415 mm de Hg, si la temperatura permanece constante?
Problema 2.-
Un gas ocupa 1.5 litros a una presión de 2.5 atm. Si la temperatura
permanece constante, ¿Cuál es la presión en mm de Hg, si se pasa a un
recipiente de 3 litros?
Problema
3.- Calcular el volumen de un gas a una temperatura constante al
recibir una presión de 5 atm, si su volumen es de 3.4 litros a una presión de
2.5 atmósferas.
EJERCICIOS
PROPUESTOSTOS: LEY DE GAY LUSSAC
Problema 1.- Un gas, a una temperatura de
35°C y una presión de 440 mm de Hg, se calienta hasta que su presión sea de 760
mm de Hg. Si el volumen permanece constante, ¿Cuál es la temperatura final del
gas en °C?
Problema 2.- La presión del aire en un matraz
cerrado es de 460 mm de Hg a 45°C. ¿Cuál es la presión del gas si se calienta
hasta 125°C y el volumen permanece constante?
Problema 3.- Un gas contenido en un recipiente se
encuentra sometido a una presión de 2 atmósferas a la temperatura de 27°C. ¿qué
temperatura adquiere si se le aplica una presión de 3 atmósferas?
Problema 4.- Un gas produce una presión de 4
atmósferas a la temperatura de 47°C. ¿Qué presión produce a la temperatura de
127°C?
Problema 5. Un gas, a una temperatura de 35°C y una
presión de 440 mm de Hg, se calienta hasta que su presión sea de 760 mm de Hg.
Si el volumen permanece constante, ¿Cuál es la temperatura final del gas en °C
Problema 6. Una cierta cantidad de gas se encuentra
a la presión de 790 mm Hg cuando la temperatura es de 25ºC. Calcula la presión
que alcanzará si la temperatura sube hasta los 200ºC.
Problema 7. Si cierta masa de gas contenido en un
recipiente rígido a la temperatura de 100ºC posee una presión de 2 atm, ¿qué
presión alcanzará la misma cantidad de gas si la temperatura aumenta a 473 K.
Problema 8. Un gas recibe una presión de 3
atmósferas, su temperatura es de 280 grados Kelvin y ocupa un volumen de 3.5
metros cúbicos. El volumen es constante y la temperatura aumenta a 310 grados
Kelvin. ¿Cuál es ahora la presión del gas?
a) ¿Cuál es la presión absoluta que
tiene el gas encerrado en el tanque?
b) ¿Cuál es la presión manométrica?
Problema 10. Una masa dada de gas en un recipiente
recibe una presión absoluta de 7 atmósferas, su temperatura es de 57°C y ocupa
un volumen de 300 cm³. Si el volumen del gas permanece constante y su
temperatura aumenta a 95°C, ¿cuál será la presión absoluta del gas?
EJERCICIOS PROPUESTOS SOBRE LA LEY DE CHARLES.
Problema1.- A presión constante un gas ocupa 1.500 (ml) a 35º C ¿Qué temperatura es necesaria para que este gas se expanda 2,6 L?
Problema 2.- El volumen inicial de una cierta
cantidad de gas es de 200 mL a la temperatura de 293,15 K. Calcule el volumen
del gas si la temperatura asciende a 363,15 K y la presión se mantiene
constante.
Problema 3.- Una masa de oxígeno ocupa 200 mL a
100°C. Determine su volumen a 0°C, si la presión se mantiene constante.
Problema 4.- Una cantidad fija de gas a 296,15 K
ocupa un volumen de 10,3 L, Determine la temperatura final del gas si alcanza
un volumen de 23 L a presión constante.
Problema 5.- ¿Qué volumen ocupa un gas
a 30º C, a presión constante, si la temperatura disminuye un tercio (1/3)
ocupando 1.200 cc?
Problema 7.- una determinada cantidad de neón ocupa
0,3 litros a 200ºC. Calcular el volumen que ocuparía a 0ºC si la presión se
mantiene constante.
Problema 8.- una determinada cantidad de oxígeno
ocupa 2,5 litros a 50ºC. Calcular la temperatura (en grados centígrados) a la
que ocupará 1 litro si la presión permanece constante.
Problema 9.-
una determinada cantidad de neón ocupa 0,3 litros a 200ºC. Calcular el volumen
que ocuparía a 0ºC si la presión se mantiene constante.
Problema
10.- una determinada cantidad de oxígeno ocupa 2,5 litros a 50ºC. Calcular
la temperatura (en grados centígrados) a la que ocupará 1 litro si la presión
permanece constante.
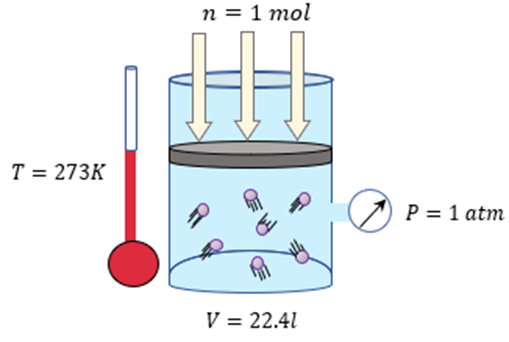
EJERCICIOS PROPUESTOS SOBRE LOS GASES IDEALES
Problema 1. calcular el volumen de 6,4 moles de un gas a 210ºC
sometido a 3 atmósferas de presión.
Problema 2. calcular el número de moles de un gas que tiene un
volumen de 350 ml a 2,3 atmósferas de presión y 100ºC.
Problema 3. ¿Cuál es el
volumen en litros que ocupa un gas ideal si 0,222 moles se encuentran a una
temperatura de 159 °C y a una presión de 1148 mmHg ?
Problema 4. ¿Cuál es la temperatura en K de un gas ideal, si
0,405 moles ocupan un volumen de 7720 mL a la presión de 790 mmHg ?
Problema 5. ¿Cuál es la presión en atm de un gas ideal, si 0,532
moles ocupan un volumen de 4390 mL a la temperatura de 183,93 K ?
Problema 6. Un kilomol de gas ideal ocupa 22.4 m3 a 0 °C y 1 atm. a) ¿Cuál es la presión que se requiere para comprimir 1.00 kmol de gas en un contenedor de 5.00 m3 a 100 °C? b) Si se va a encerrar en un tanque de 5.00 m3 , el cual puede resistir una presión manométrica máxima de 3.00 atm, ¿cuál sería la máxima temperatura del gas si se desea que el tanque no estalle? Resp. a) 6.12 atm; b) –30 °C
Problema 7.
Un tanque de 5000 cm3 contiene un gas ideal (M = 40 kg/kmol) a una presión
manométrica de 530 kPa y a una temperatura de 25 °C. Si se supone que la
presión atmosférica es de 100 kPa, ¿qué cantidad de masa de gas se encuentra en
el depósito? Resp. 0.051 kg
Problema 8.
La presión de aire en un vacío razonablemente bueno podría ser de 2.0 x 10-5
mmHg. ¿Qué masa de aire existe en un volumen de 250 mL a esta presión y a 25
°C? Tómese M = 28 kg/kmol para el aire. Resp. 7.5 x 10-12 kg
Problema 9.
¿Qué volumen ocupará 1.216 g de SO2 gaseoso (M = 64.1 kg/kmol) a 18.0 °C y 775
mmHg, si este actúa como un gas ideal? Resp. 457 mL
Problema 10. Calcúlese la densidad del H2S gaseoso (M = 34.1 kg/kmol) a 27 °C y 2.00 atm, considerándolo como gas ideal. Resp. 2.76 kg/m3