|
INSTITUCIÓN EDUCATIVA DISTRITAL
TÉCNICO INDUSTRIAL Ciencia, Técnica y Valores Humanos |
|
|
PLAN DE CLASE COMPETENCIAS
CIENTIFICAS. GRADO 8° |
|
|
Fecha de emisión: 08 - 01 – 2024 |
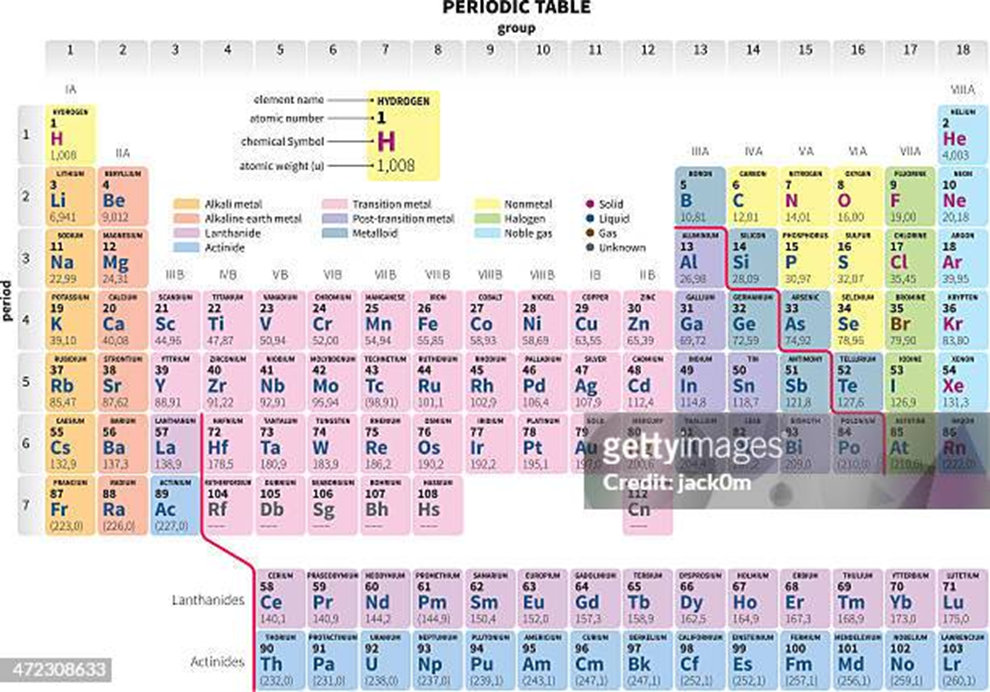
LA TABLA PERIÓDICA.
ESTANDARES:
Ø
Explico y utilizo la tabla periódica como
herramienta para predecir procesos químicos.
Ø
Establezco relaciones entre las características
macroscópicas y microscópicas de la materia y las propiedades físicas y
químicas de las sustancias que la constituyen.
Supongamos que usted fue a la tienda de videos y todos se mezclaron.
¿Cómo distinguir las comedias de las películas de acción? Si los videos no
estuvieran organizados en un patrón, ¡no sabría qué tipo de película ha
elegido! ¿Cómo los organizaría usted? Miremos qué pasa con la tabla periódica.
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
En 1912, Henry Moseley ordeno los elementos de la tabla periódica
usando como criterio la clasificación del número atómico (Z), ya que este valor
es el mismo para todos los átomos de un elemento químico. La tabla periódica
moderna ordena 118 elementos que se conocen actualmente según su número atómico
(Z).
- Símbolos: El
símbolo es la representación del elemento. Cuenta con una letra
mayúscula y en ocasiones, se acompaña por otras minúsculas, dependiendo
del caso.
- Número atómico:
Cada átomo cuenta con un número atómico. Éste es igual a la cantidad
de protones con los que cuenta su núcleo. Dicho número diferencia un
elemento de otro. Suele colocarse antes del elemento en sí. Por
ejemplo, el boro (B), cuenta con el número 5. Éste es su número
atómico. Cuenta con 5 electrones alrededor del núcleo y 5 protones en
su núcleo.
La tabla periódica no solo es una manera de ordenar los elementos
químicos. Su organización en grupos y períodos nos dicen mucho más sobre un
elemento químico que solo su ubicación. Sabiendo a qué período y a qué grupo
pertenece un elemento, podemos saber mucho acerca de su naturaleza y
propiedades.
Los elementos se disponen en filas horizontales llamada periodos y
en columnas denominadas grupos.
Períodos
Si ahora nos centramos en las filas horizontales entonces nos
encontraremos períodos. Dependiendo de a qué periodo pertenece a cada
elemento, nos indicará el número de niveles energéticos de un átomo. Están
organizados por niveles ya su vez subniveles, pero siempre, los elementos se
seguirán organizando según su número atómico.
- Periodo 1: En el periodo uno tan solo
contamos con dos elementos químicos. El hidrógeno y el helio.
- Periodo 2: En
este caso, el número atómico aumenta un poco más y nos encontraremos con
un total de ocho elementos entre los que se encuentran carbono, boro, o
nitrógeno, entre otros como vemos en la tabla periódica de abajo.
- Periodo 3: El
sodio, magnesio, aluminio, silicio, fósforo o azufre, se encuentran en
este periodo.
- Periodo 4: La
cuarta fila de la tabla periódica ya cuenta con más elementos. Un
total de 18 serán los que se sitúen en ella. Podemos mencionar tanto
el potasio como el calcio o el hierro y el zinc.
- Periodo 5: Pues
como bien sabemos ya, se corresponde a la quinta fila de la tabla de los
elementos. También cuenta con un total de 18. Aquí nos encontraremos
con el estroncio o el paladio.
- Periodo 6: Otros
18 elementos se encuentran en la llamada fila sexta, o periodo 6. Algunos
de ellos son cesio, wolframio o el mercurio.
- Periodo 7:
Los elementos más radiactivos e inestables se encuentran en este
periodo. Se incluyen también los actínidos.
A excepción del Hidrógeno, los períodos inician con un metal alcalino y
terminan con un gas noble.
Grupos
Los grupos son las columnas de la tabla, y sus elementos
poseen una disposición similar de electrones externos, por lo que forman
familias con propiedades químicas similares.
- Grupo 1: En él nos encontraremos con los metales
alcalinos. Lo componen los elementos, litio (li), sodio (Na), potasio
(K), rubidio (Rb), cesio (Cs), francio (Fr).
- Grupo 2: En este segundo grupo veremos los metales
alcalinotérreos. Son más duros que los anteriores y buenos
conductores eléctricos. Aquí nos encontraremos con berilio (Be),
magnesio (Mg), calcio (Ca), estroncio (Sr), bario, (Ba) y radio (ra).
- Grupo 3 o IIIB: Familia del Escandio. Entre ellos se
encuentran el escandio (Sc) y el itrio (Y). Aunque son un tanto
discutidos, también hay mencionar que el lantano (La) y el actinio (Ac).
- Grupo 4 o IVB: Es la familia del Titanio. En ella nos encontramos con el
titanio (ti), circonio (Zr), hafnio (Hf) y rutherfordio (Rf).
- Grupo 5 o VB: Dentro de la familia del Vanadio, nos vamos a encontrar con el
vanadio (V), niobio (Nb), tántalo (Ta), dubnio (Db).
- Grupo 6 o VIB: En este grupo nos encontramos con la familia
del cromo. Allí veremos al cromo (Cr), molibdeno (Mo), wolframio (W),
seaborgio (Sg).
- Grupo 7 o VIIB: manganeso (Mn), tecnecio (Tc) y renio (Re), Todos ellos pertenecen a
la familia del Manganeso.
- Grupo 8 u VIIB FILA1: La familia del hierro está compuesta de hierro (Fe), rutenio (Ru),
osmio (Os), Hassio (Hs).
- Grupo 9 u VIIIB FILA 2: Aquí nos encontramos con el cobalto (Co), rodio (Rh), Iridio (Ir),
meitnerio (Mt).
- Grupo 10 u VIIIB FILA 3: La familia del Níquel la componen el níquel (Ni), paladio (Pd),
platino (Pt), darmstadtio (Ds).
- Grupo 11 o IB: El cobre (Cu), plata (Ag) y oro (Au) se les conoce como metales de
acuñar, aunque no es un término que todos acepten.
- Grupo 12 o IIB: El zinc (Zn), el cadmio (Cd) y el mercurio (Hg).
- Grupo 13 o IIIA: El llamado grupo 13 también corresponde con el grupo del
boro. Un nombre que le viene de la tierra, puesto que es en ella
donde más abundan. Nos encontramos con boro (B), aluminio (Al), galio
(Ga), indio (In), talio (Ti) y nihonio (nh).
- Grupo 14 O IVA: En el grupo del carbono o carbonoideos, nos encontramos con el
carbono (C), silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb),
flerovio (FI).
- Grupo 15 o VA: En este caso llegamos al grupo del nitrógeno. Como no,
comenzamos con el nitrógeno (N), fórforo (P), arsénico (As), antimonio
(Sb), bismuto (Bi) y moscovio (Mc).
- Grupo 16 O VIA: Se le conoce como el grupo de los Anfígenos,
aunque no pueden ocultar su condición de familia del oxígeno. Así es
que nos encontramos con el oxígeno (O), azufre (S), selenio (Se), telurio
(Te), polonio (Po), livermorio (Lv).
- Grupo 17 o VII: Los halógenos se encuentran en este grupo. Flúor (F), cloro
(CI), bromo (Br), yodo (I), astato (At), téneso (Ts).
- Grupo 18 u VIIIA: Los llamados gases nobles son otro de los grupos de elementos que
cuentan con unas propiedades muy parecidas. En unas condiciones
normales, se dice que son gases incoloros e inodoros. Los gases son
el helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), radón (Rn)
y organesón (Og).
Taller de aplicación del Saber
1. ¿Qué diferencia hay entre el
grupo y el periodo?
2. Diga falso o verdadero:
A. La tabla periódica presenta los elementos clasificados según su peso
atómico. ( )
B. Los periodos también se llaman familia. ( )
C. En un átomo neutro, el número atómico indica la cantidad de protones
o de electrones ( )
D. Todos los elementos del grupo IA son metales alcalinos. ( )
E. El C y Si pertenecen a la misma familia ( )
F. El Li, F, N y B pertenecen al mismo periodo. ( )
G. El Fe, Co, Ni, Mn y Au son elementos de transición. ( )
H. El At, Mg, B, N y Ra son elementos representativos. ( )
Mira atentamente los colores en la tabla periódica anterior. Ellos nos muestran
una forma en la que están organizados los grupos en la tabla periódica:
Dibuja en una hoja la tabla periódica e Indica en donde se
encuentran los siguientes grupos de elementos, resaltándolos con un color
característico. Por ejemplo, los lantánidos son naranjas entonces coloréalos de
naranja.
- metales alcalinos
- metales
alcalinotérreos
- metales de transición
- metaloides
- no metales
- gases nobles
- lantánidos
- actínidos
2. Escribe al frente del símbolo químico el nombre del elemento correspondiente. Cr __________ Au ____ Pd _______ Na _______ K________ Cl_______ Mg ________ Ca _______ Ge_______ Ni_______ Ag_______ Hg__________ N________ C________ B_______ Al__________
3. Escribe al frente del nombre del elemento el símbolo químico correspondiente. Plomo __ Azufre __ Cobalto __ Litio __ Francio __ Cobre __ Berilio __ Galio __ Selenio __ Fósforo __ Antimonio __ Hierro __ Platino __ Manganeso __ Zinc __ Hidrógeno __ Oxígeno __ Radio __ Iodo __
4. ACTIVIDAD DE PROFUNDIZACIÓN. Investiga la historia de la tabla periódica. ¿Qué son elementos sintéticos y elementos naturales? ¿Cuáles son los últimos elementos químicos descubiertos?



No hay comentarios:
Publicar un comentario