|
INSTITUCIÓN
EDUCATIVA DISTRITAL TÉCNICO INDUSTRIAL Ciencia, Técnica y Valores
Humanos |
|
|
Plan
de clase de química 1° periodo |
UNIDAD 1 TEMA 3:
CÁLCULOS EN LAS REACCIONES QUIMICAS.
LOGRO: Realiza
los ajustes de las reacciones químicas para calcular las cantidades de los
reactivos o productos según sea el planteamiento presentado.
La estequiometría se encarga de hacer cálculos matemáticos a partir de ecuaciones químicas balanceadas. Una ecuación química balanceada permite averiguar las cantidades de los reaccionantes que se requieren para formar cierta cantidad de producto.
Los cálculos estequiométricos se basan en las relaciones fijas de combinación que hay entre las sustancias. Dichas relaciones están indicadas por los índices numéricos que aparecen en las fórmulas y por los coeficientes de las ecuaciones balanceadas.
Los cálculos estequiométricos requieren una unidad química que relacione los pesos de los reactantes con los pesos de los productos. Esta unidad es la mol.
Una mol es una cantidad de material que contiene el número de Avogadro de partículas: 6.02 x 1023. Una mol corresponde en gramos, al peso fórmula (peso atómico o molecular) de una sustancia. Por ejemplo, una mol de SO2 pesa 64 gramos y contiene 6.02 x 1023 moléculas. Una mol de átomos de H contiene 6.02 x 1023 átomos de este elemento y su peso es 1 gr. Entonces resaltamos el concepto:
Un
mol de una sustancia es una cantidad equivalente a la que representa su masa
atómica en umas expresada en gramos. En un mol de una sustancia hay 6,022 . 1023 partículas (átomos, moléculas,
iones...)
Número de moles
El número de moles se refiere a la cantidad de estas unidades presentes en una muestra. Se representa con la letra n.Para calcular el número de moles se divide el valor en gramos de la muestra por el peso de un mol de dicha muestra. Es decir,
n = gramos de la muestra ÷ peso de 1 mol de la muestra
En 160 gramos SO3 hay 2 moles porque, S = 32; O = 16 × 3 = 48;
Peso molecular = 32 + 48 = 80 gr/mol
n = 160 g ÷ 80 gr/mol = 2 moles
Cálculos que se pueden obtener de una ecuación química:
- La cantidad de
producto que se puede preparar a partir de ciertas cantidades de reactivos.
- El reactivo limite,
el cual determina que tanto producto se puede obtener de una ecuación
química, cuando no se dispone de una cantidad limitada de uno de los
reactivos.
- Los porcentajes de
producción.
- La pureza del
compuesto.
¿Cómo hallar la cantidad de un producto que se puede preparar a partir de ciertas cantidades de reactivos?
Una reacción química balanceada indica la cantidad exacta de producto que se obtiene a partir de cantidades exactas de reactivos. Por ejemplo:
Esta reacción indica que 2 moles de KClO3 producen 2
moles de KCl y 3 moles de O2. Si el análisis se hace en gramos, se
establece que 245,1 gr de KClO3 producen 149,1 gr de KCl y 96
gr de O2.
Cálculos mol-mol
Cuando se conocen los moles que participan en una reacción y se tiene
la ecuación balanceada, se establece una relación molar entre reactivos y
productos, teniendo en cuenta que los moles en una ecuación están dados por los
coeficientes estequiométricos.
Ejemplo:
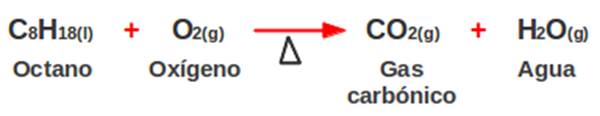
La combustión del octano, uno de los componentes de la gasolina,
produce gas carbónico, agua y cierta cantidad de calor (proceso exotérmico), de
acuerdo con la siguiente reacción:
Cuando se quema una muestra de gasolina que contiene 38,5 moles de
octano, ¿cuántos moles de gas carbónico se producen y cuántos moles de agua se
forman en la combustión?
Solución: planteamos y balanceamos la ecuación:
Establecemos el factor molar, teniendo en cuenta los coeficientes
estequiométricos:
Se forman 346,5 moles de H2O cuando se queman 38,5 moles de
C8H18.
Cálculo masa-masa
En este tipo de cálculos químicos, las cantidades de las sustancias se
expresan en gramos; estos cálculos son conocidos como relación masa-masa. Para resolver
este tipo de cálculos, se convierten a moles las cantidades de las sustancias;
se establece la relación molar entre ellas y, por último, se convierten los
moles a gramos para dar la respuesta.
Ejemplo:
El ácido nítrico (HNO3) se emplea para producir el explosivo
trinitrotolueno (TNT). La ecuación que nos representa esta relación es:
Cálcula los gramos de TNT que se producen al hacer reaccionar 500 g de
tolueno del 100% de pureza con la cantidad suficiente de ácido nítrico (HNO3),
ácido sulfúrico y calor.
Solución: planteamos y balanceamos la ecuación:
Masa molecular del tolueno (C7H8) = 92 g/mol.
Masa molecular del TNT (C7H5N3O6)
= 227 g/mol.
Determinamos el número de moles del tolueno (C7H8):
Establecemos el factor molar entre el tolueno (C7H8) y el
TNT (C7H5N3O6), teniendo en cuenta los
coeficientes estequiométricos:
Como la respuesta debe expresarse en unidades de masa (g), convertimos
los moles de TNT a gramos:
También se pueden resolver si se convierten a gramos las moles de los
reactivos y los productos, que nos suministra la ecuación balanceada y luego,
realizar una regla de tres simple, para obtener el resultado en gramos.
Pueden efectuarse cálculos estequiométricos cuando unas cantidades de
sustancia se expresan en moles y otras en masa; este tipo de relaciones se
conocen como mol-masa o, también, masa-mol. Para realizar esta serie de conversiones,
se convierte, primero, la masa de la sustancia a moles, empleando la masa
molecular y, luego, se siguen los pasos descritos en los casos anteriores.
Ejemplo:
El amoníaco se oxida a 850°C en presencia del platino, produciendo
monóxido de nitrógeno (NO) y agua en el proceso Ostwald. Si se oxidan 5,8 moles
de amoníaco, ¿cuántos gramos de NO se producen?
Solución: planteamos y balanceamos la ecuación:
Hallamos las masas moleculares del NH3 y del NO:
Masa molecular del NH3 = 17 g/mol.
Masa molecular del NO = 30 g/mol.
Hallamos los moles de NO, estableciendo el factor molar:
Convertimos los mo
les de NO a g para dar la respuesta:Se producen 174 g de NO cuando se oxidan 5,8 moles de NH3.
3. CIERRE









No hay comentarios:
Publicar un comentario